|
||
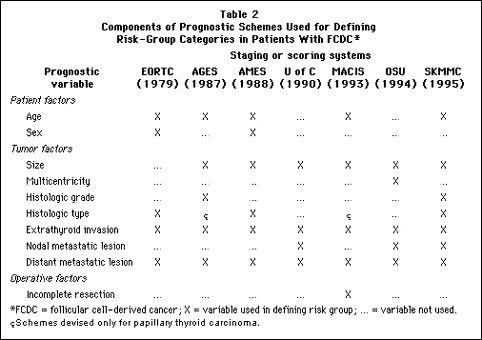
| 過去10年の間に、国際癌防止連合(UICC)とアメリカ癌合同委員会(AJCC)は甲状腺の癌腫におけるステージングシステムのための規則に関し、合意に達しました。AJCC分類はTNMシステムに基づいたもので、それは3つの要素の評価によるものです。 原発性腫瘍の範囲(T)、局所リンパ節への転移のあるなし(N)、そして離れた場所への転移のあるなし(M)です。 これら3つの要素の数を足すことによって、悪性病変の範囲が示されます。 つまり、腫瘍のサイズの進行的増大や冒された範囲を示すことができるのです。TNM分類は治療前に得られた証拠(FNA生検を含む)に基づいた臨床TNM(cTNM)、あるいは術中および外科病理学的データが入手できる場合の病理学的TNM(pTNM)のどちらでもかまいません。もちろん、原発性腫瘍の正確なサイズが特定でき、組織学的タイプの確認が可能で、甲状腺外浸潤も明確に示されるため、pTNM分類の方が好ましいのです。 通常は、原発性腫瘍の状態は、原発性病変のサイズ(T1, 最大直径が1cm以下;T2, 最大直径が1cm以上4cm以下;T3,4cm以上)または甲状腺外に直接広がっているか、あるいは甲状腺被膜を通って浸潤がある(T4)かに基づいて定められます。 甲状腺癌には4段階のT、2段階のN、そして2段階のMがあるため、TNMを16の異なったカテゴリーに分けることができます。要約と分析の目的のため、AJCCはこれらのカテゴリーを使いやすいTNMステージの数にまとめました【表1】。 |
||
|
||
| 一般的に、頭部や頚部の癌はすべて解剖学的な広がりの範囲に基づいて段階分けされるのですが、甲状腺癌の段階分けは、予後に重要な影響があるため、組織学的診断と患者の年齢を含める点がユニークです。 このステージングシステムにもとづけば、若いFCDC患者(年齢45歳未満)は離れた場所に転移がなければすべてステージIとなります。−この状況では、ステージIIのものも存在するだろうと思われます。年齢の高い患者(45歳以上)で、リンパ節転移のない乳頭状または濾胞状の微小癌があるものはステージIとなります。腫瘍のサイズが1.1cmと4cmの間のものはステージIIとなり、年齢の高い患者でリンパ節転移があるか、または甲状腺外への浸潤のどちらかがあるものはステージIIIに分類されます。髄様癌に関しては、体系は同じで、微小癌はステージI、そしてリンパ節転移がプラスのものはステージIIIとなります。ただし、髄様癌には年齢による区別はなく、局所(甲状腺外)浸潤があればステージIIとされます。髄様癌患者と年齢の高いFCDC患者では、ステージIVは離れた場所に転移があることを表わします。腫瘍の範囲には関係なく、未分化癌のある患者はすべてステージIVと見なされます。 pTNMシステムは、もっとも広く受け入れられている甲状腺癌のステージングで、疾患の広がりの範囲の評価に使われる道具としてAACEもこれを推奨しています。これはアメリカの病院が甲状腺癌の新しい症例を報告する際に使う標準システムです。実際には、甲状腺癌の臨床的広がりを表わす“略号表記”です。しかし、これが特定のリスクグループに入る一人の患者を分類するために、臨床家が必要とするであろうすべての情報を与えてくれるものではありません。リスクの特定を修正し、より正確なものにするためには、厳密な多変数分析で、結果の独立予測因子として表わされる別の予後指標を考慮する必要があると思われます。 |