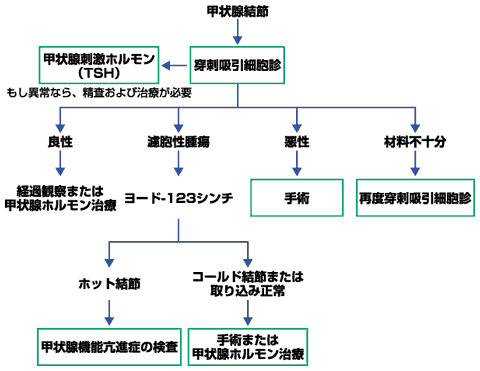
| 【図】は提唱された甲状腺結節の検査と管理方法の概要を示したものである。ヨード-123シンチが、穿刺吸引細胞診で濾胞性腫瘍が見つかった場合に役立つと思われる。しかし、良性の機能亢進結節が、機能していない良性の濾胞性腫瘍や濾胞癌と細胞学的に鑑別できない場合があるからである(1)。先に述べたように、機能亢進結節が悪性であることはまずない。 | ||
|
||
|
悪性でないことがわかった、あるいは悪性である可能性がまずないと思われる結節のある患者には、検査や画像診断法、針生険およびレボサイロキシンナトリウム<T4:注釈:日本ではチラーヂンS>によるTSH抑制療法などを慎重に用いて、長期にわたり定期的に臨床観察を行う必要がある。フォローアップの目標は、1]局所的な圧迫による合併症や美容的問題を起こす、あるいは悪性の徴候とも考えられる進行性の腫大を見分けること、2]関連のある臨床的または無症候性甲状腺機能障害の診断、そして、3]未診断または続発性の甲状腺悪性腫瘍がある可能性のある患者を見分けることである。 定期的診察には、1]結節または甲状腺腫の進行性腫大、2]局所的な圧迫症状や浸潤性の症状(すなわち嚥下困難、呼吸困難、咳、痛み、声のしゃがれ)、3]その他、未確認の甲状腺悪性腫瘍の転移をうかがわせるような頸部や肺、あるいは骨の症状、そして4]特に機能性の腺腫または慢性甲状腺炎の人では、甲状腺機能亢進症や機能低下症をうかがわせる症状などの確認に重点をおいた病歴採取を含めるべきである。 |